# 摘要#
本文对药物研发过程中小分子化合物的结构确证工作进行梳理和概括。

1小分子化合物进行结构确证的一般顺序
小分子化合物一般是通过定向合成、天然产物提取、发酵提取或半制备等方式制备得到。
首先需要通过定向合成、天然产物提取、发酵提取或半制备等方式制备得到目标产品,通过液相或气相等检测手段评估纯度(原料药纯度通常≥99.0%)后,主要通过核磁共振氢谱(1H-NMR)、光谱及常规质谱(MS)等方法,基于合成机理推断平面结构;如合成机理不明确,采用提取方式获得,或氢谱及质谱等常规方法对化合物结构判断的信息作用不大,则需要投入更多确证方法来辅助结构判断,如借助碳谱(13C-NMR),二维核磁等来确证;在解析得到平面结构后,如判断存在立体构型,应采用针对立体结构相应的研究手段,如NOESY、圆二色谱(CD)、单晶衍射等进行确证。

2小分子化合物进行结构确证的研究手段
化合物结构初步确证后,按照相关指导原则,根据化合物类别,对原料药(新化学实体、已知化合物)、起始物料/中间体/杂质(新化合物、已知化合物)结构确证的相关研究内容见表1。
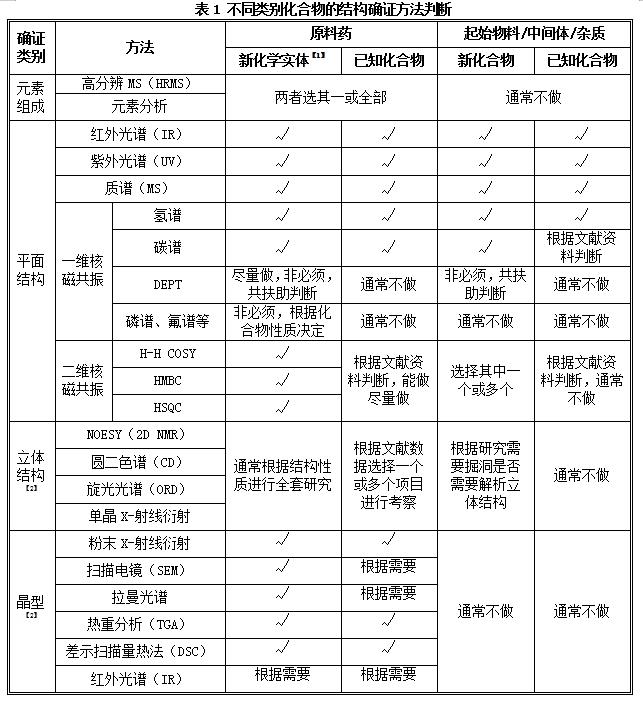
备注说明:
【1】根据国家局2018年发补的《新药I期临床试验申请技术指南》,“在研发早期,应对样品进行初步结构确证,提交研究数据。完整的结构确证数据可在申报新药上市时提交,包括一级结构、二级结构和高级结构等”
【2】如化合物为平面构型、不存在立体构型或多晶型,不需研究。
3结构确证总结
下文是对结构确证相关技术进行的简单阐述,因结构解析是一门系统的学科,内容较多且精深,在此不做具体结构解析的陈述。
3.1 高分辨质谱(HRMS)/质谱(MS) 与常规质谱相比,高分辨质谱(HRMS)测得化合物的分子量可精确至小数点后第四位,常用于辅助确定化合物的分子质量和和分子式,前提是通过核磁共振波谱已初步确定化合物结构。某些情况下,质谱可以起到结构确证的关键作用。质谱解析中还有一条大家都比较熟悉的“氮规则”:化合物分子不含氮或含偶数个氮原子时,其分子离子的质量是偶数;化合物分子含奇数个氮原子时,其分子离子的质量是奇数。
3.2 元素分析 元素分析对化合物中的各元素进行含量测定,确定各元素的百分含量。针对各元素的特点,元素分析可选择的方法较为多样。碳、氢、氮元素检测通常采用燃烧分解法;含卤素或硫的化合物,采用氧瓶燃烧-滴定法(中国药典2020年版四部通则0703);金属元素可采用电感耦合等离子发射光谱法(ICP-OES);磷元素可采用酸分解-比色法等。测定完毕,比较测试结果与理论结果差值的大小,2005年发补的《化学药物原料药制备和结构确证研究技术指导原则》[1]规定“一般要求误差不超过0.3%”,在实际遇到的一些案例中,会存在样品容易吸潮或化合物含较多游离水,导致测试结果与理论结果误差超过0.3%。在元素分析解析时,建议元素百分含量测定值扣除化合物的水分测定结果后,再与理论值比较误差。
3.3 一维核磁共振波谱 取化合物2mg~10mg装入核磁管,用合适的氘代试剂进行溶解,用核磁共振波谱仪(频率通常400M~800M)进行检测,内标物为四甲基硅烷(TMS)。1H的天然丰度较13C高很多,核磁测试时,两者频率通常是4倍关系,如氢谱(1H NMR)600M频率对应碳谱(13C NMR)150M频率;碳谱的响应较氢谱低,如果化合物量较少,在测试碳谱时,可通过积累扫描时长增加碳谱的响应;分子量大的化合物较分子量小的化合物检测用量要多。氘代试剂的选择也非常关键,比较常见的氘代试剂有DMSO-d6,CDCl3,D2O,Methanol-d4,(CD3)2CO等。某些情况下,化合物的化学位移可能与氘代试剂(或氘代试剂中存在的水)在氢谱或碳谱中的化学位移重叠,影响结构确证,就需要更换氘代试剂进行测定。指导原则[1]规定“对含有活泼氢的药物必需进行氘代实验,以提供活泼氢的存在以及位置的信息。”,选择氘代试剂时,可采用重水交换来确认活泼氢的存在。同时,可结合二维1H-1H COSY谱进行确认。
3.4 二维核磁共振波谱 二维核磁共振波谱是对平面结构进行确证的关键。常用的为:
常用的为:HMBC(检出1H异核多键相干技术)、HSQC(检出1H异核单量子相干技术)、COSY(同核位移相关谱)、NOESY(核极化效应相关谱)。HMBC对推断结构最为高效,它是看相隔2个或3个键氢原子与碳原子的远程相关性;COSY(通常是1H-1HCOSY)看相邻碳相连氢原子的相关性;HSQC看直接相连的碳氢相关性。通常通过这三种技术,即可初步确认化合物的平面结构。
3.5 圆二色谱(CD) 圆二色谱(CD)是用于推断非对称分子的构型和构象的一种旋光光谱,可用于确证化合物的绝对构型。
3.6 单晶X-射线衍射(XRSD)单晶X-射线衍射(XRSD)也是确定绝对构型的常用方法,可测定晶态分子的晶胞参数、晶系、空间群,可提供一个化合物在晶态中所具有原子的精确空间位置。该技术主要涉及单晶培养和检测。晶体培养难度较大,需不断尝试且有足够耐心。剑桥晶体数据中心(CCDC, the Cambridge Crystallographic Data Centre)自1965年起就从事晶体数据的收集、整理与计算机化工作,该中心发展的剑桥结构数据库系统CSDS(CSDS,the Cambridge Structural Database System)是基于X光和中子衍射实验唯一的小分子及金属有机分子晶体的结构数据库(网址:https://www.ccdc.cam.ac.uk/structures/),其中收录了113万多化合物的晶体结构,每一个化合物均有自己的CCDC编号。
3.7 其他结构确证技术除上述结构确证方法外,还有很多其他的结构确证技术,如红外、紫外、拉曼光谱、热重分析(TG)、差示扫描量热法(DSC)、旋光光谱等。
红外光谱、热重分析(TG)、差示扫描量热法(DSC)、偏光显微镜法等对化合物晶型的判断也可起到辅助作用。
某些化合物在固态时会表现出多晶型,多晶型会表现出红外光谱的差异;通常,结构中微小的差别会使红外光谱有很明显的差别。
老药组胺H2受体阻抗剂“西咪替丁”,参比制剂使用的原料药为A晶型,其原料药还存在另外三种晶型B、C、D,此外还有混合晶型。ABCD这四种晶型在红外光谱中的吸收存在微小差异(见下表),根据这些差异,可采用红外光谱来对A晶型产品进行鉴别[2]。此外,DSC也显示A晶型和B晶型在起始熔点和最高吸热峰存在差异,可用于晶型鉴别[3]。

总结:本文对小分子化合物的结构确证方法进行了初步汇总,实际工作中,因化合物结构和性质差异,对结构确证技术方法的选择和应用应仔细剖析后使用。
参考资料:
[1] 化学药物原料药制备和结构确证研究技术指导原则(2005年)
[2] Bela Hegedüs, Sándor Gorog. The polymorphismof cimetidine[J]. Journal of Pharmaceutical & Biomedical Analysis,1985, 3(4):303-313.
[3] 尹华, 杨腊虎, 等. 西咪替丁的晶型研究[J]. 药物分析杂志, 2001, 21(1):39-42.

 企业邮箱
企业邮箱 企业OA
企业OA