由于细胞和人体组织屏障的存在,导致许多有价值的药物分子无法透过生物膜渗透进入细胞和人体组织内部发挥功效。为了实现跨生物膜运输,药物通常具备高度亲脂性(Lipophilic)或较小的化学结构。越来越多的生物活性大分子药物如多肽、寡核苷酸、蛋白质被转化到了临床研究阶段,与小分子药物相比,特异性更高、耐受性更好。然而,这些生物活性分子通常亲水性(Hydrophilic)较高,生物膜渗透性(Membrane Permeability)差,无法进入细胞内部与疾病靶点结合,大大限制了其治疗价值。更具挑战性的是在治疗部分神经退行性疾病时(如帕金森综合症),如何让上述亲水性药物分子通过血脑屏障(Blood-Brain Barrier,BBB)进入神经系统组织实质发挥药效,是一个亟待解决的重大课题。随着细胞膜穿透肽(Cell Penetrating Peptides,CPPs)的发现,借助CPPs将各种生物活性物质运送到难以进入的组织细胞内部,与疾病相关靶点结合,从而达到治疗疾病的目的。
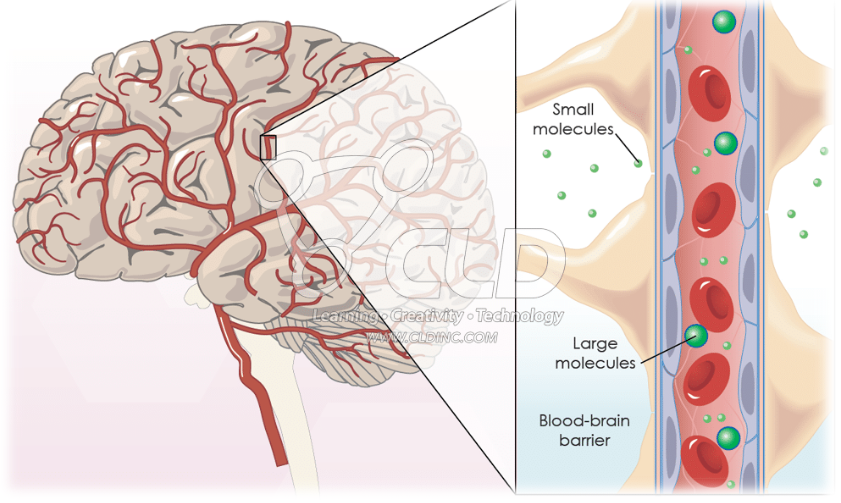
细胞膜穿透肽(CPPs)是一类由小于30个氨基酸残基组成的、能够直接穿过细胞膜进入细胞内部的多肽,也称为蛋白转导域(Protein transduction domain,PTD)或膜转运蛋白(Membranetransit protein, MTP)。CPPs不仅自身可以穿透细胞膜进入细胞,而且能够运载多种生物学活性物质(如多肽、寡核苷酸、蛋白质等大分子)进入细胞内,并发挥相应的生物学活性和治疗作用。其转导效率高且不会造成细胞损伤,这一特性保证了各种大分子药物细胞内的高效输送。
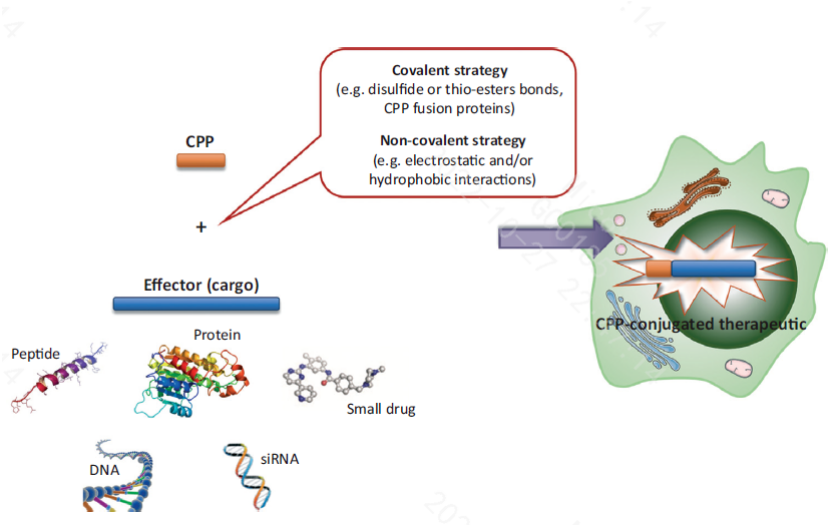
Hossein D.et al.Trends in Pharmacological Sciences, April 2017, Vol. 38, No. 4,406
CPPs的发现及研究历史
1988年Frankel等研究发现,HIV-1的转录(Transactivator of Transcription,TAT)蛋白可以经细胞外内化作用进入细胞内部,在病毒感染过程中起到了关键作用。Vivès等进一步研究表明,负责介导TAT蛋白细胞内化过程的是TAT蛋白从第48位至60位的、含有13个氨基酸残基的多肽序列。后续科学家先后发现了一系列具有细胞膜穿透能力的多肽,形成了CPPs肽家族,通常包括5-30个氨基酸,可以通过各种机制进入细胞内部,且不与特定受体发生作用。自CPPs被发现以来,越来越多地被用于基础研究(例如,作为各种类型细胞最有效的转染工具之一)以及翻译研究;借助CPP可以增加难以进入组织和细胞中的药物浓度,从而提升治疗效果;和抗菌素、抗炎药以及抗肿瘤药物等组合,用于各种类型疾病的治疗。

CPPs的分类
对于CPPs的分类,目前还没有统一的方法,通常可以按物理化学性质和来源进行分类。
2.1按物理性质分类
根据CPPs的物理化学性质差异,可以分为阳离子型(Cationic)、两亲型(Amphipathic)和疏水型(Hydrophobic)三类。
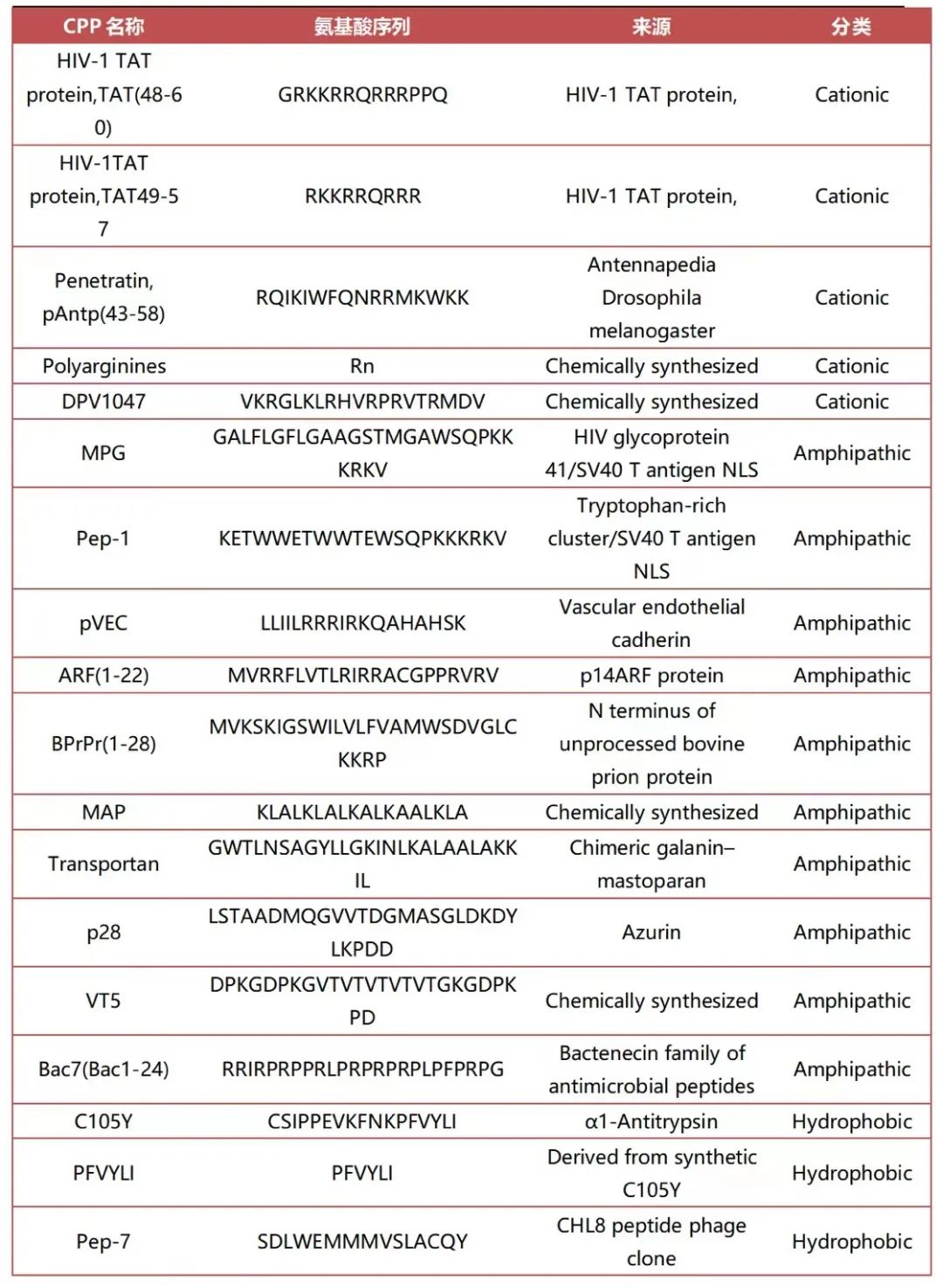
⑴阳离子型CPPs
包括在生理pH下具有高阳性净电荷的肽,主要为富含精氨酸(Arg)和赖氨酸(Lys)的短肽链。此类型的肽包括TAT衍生肽、渗透素、多聚精氨酸(PolyArg)和Diatos肽载体等。研究表明,与赖氨酸(Lys)相比,精氨酸残基对细胞内化的贡献更大。这是由于精氨酸的胍基与细胞膜中羧酸盐、硫酸盐、磷酸基团等含有负电荷的成份形成了双配位氢键,从而在生理pH条件下导致CPPs的细胞内化。
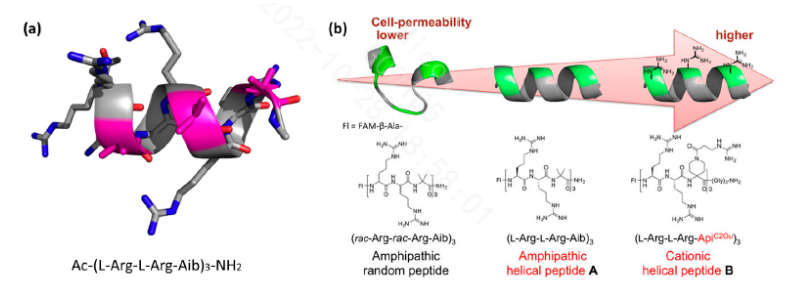
⑵两亲型CPPs
两亲性CPPs序列中同时含有极性氨基酸和非极性氨基酸。除了在整个序列中分布的赖氨酸和精氨酸外,它们还富含疏水氨基酸残基,例如缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile)和丙氨酸(Ala)。两亲性CPPs是通过共价结合疏水结构域获得的嵌合肽,这对于有效靶向细胞膜非常重要,与核定位信号(NLS)关系密切。核定位信号一种基于赖氨酸、精氨酸或富含脯氨酸(Pro)的的短阳离子肽,可通过核孔复合体(Nuclear pore complex)将肽药物靶向运送到细胞核内部。

Jana V.et.al.Materials 2019,12,2671
⑶疏水型CPPs
疏水性CPPs序列中主要包含非极性氨基酸残基,导致低净电荷。疏水氨基酸序列对细胞膜疏水结构域的高亲和力对于细胞内化过程至关重要。与阳离子和两亲性CPPs相比,目前仅发现了少量的疏水CPPs,其细胞内化机制研究的也较少。
2.2按来源分类
根据CPPs的来源不同,也可以分为三类:
⑴天然存在的CPPs
一般是指天然蛋白质的多肽区域,主要是将蛋白质向细胞内转运。例如 HIV-1的核转录激活蛋白TAT是最经典的,也是最早发现的CPPs;
⑵人工合成的CPPs
天然存在的CPPs大多富含精氨酸或赖氨酸残基,科学家们利用这一特性可合成多聚精氨酸或多聚赖氨酸类CPPs,或者从应用的角度出发对天然的CPPs进行修饰,合成一些穿膜效率更高的CPPs,例如Transportan、MPG、Pep-1等。其中,Pep-1是第一个获批上市的CPP(商品名:Chariot);
⑶嵌合而成的CPPs
一般是指由两条或以上的天然存在的序列融合而成的多肽,也属于一类人工合成的CPPs。
专业CPPs数据库的统计分析结果表明,截至目前为止大约有1700个CPPs肽序列,其中绝大部分为线性肽序列(占94.5%)。和CPPs偶联被用于生物医学研究的主要偶联物为荧光蛋白(占58.4%),然后是核酸(占16%)、蛋白质(占9%)、纳米颗粒(占7.8%)和多肽(占4.7%)。当前CPPs研究的方向主要集中在基于L-型氨基酸的合成肽方面(占84%),然后是氨基酸被修饰的CPPs(占11%),D-型氨基酸组成的CPPs约占3%,序列中同时含有L-型和D-型氨基酸的CPPs较少(约2%)。
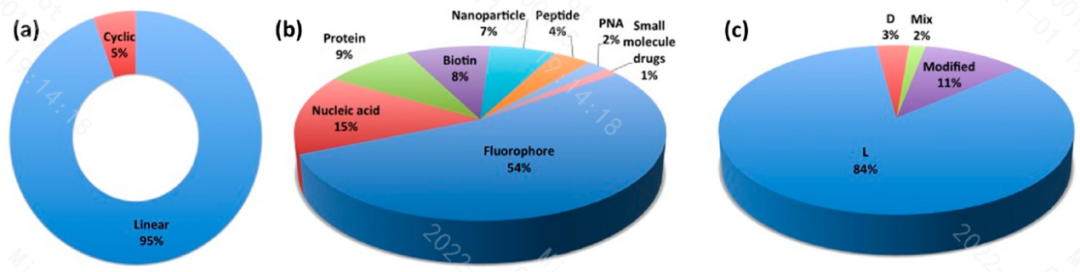
Daniela K.et.al.Molecules 2017, 22, 1929
CPPs的透膜机制
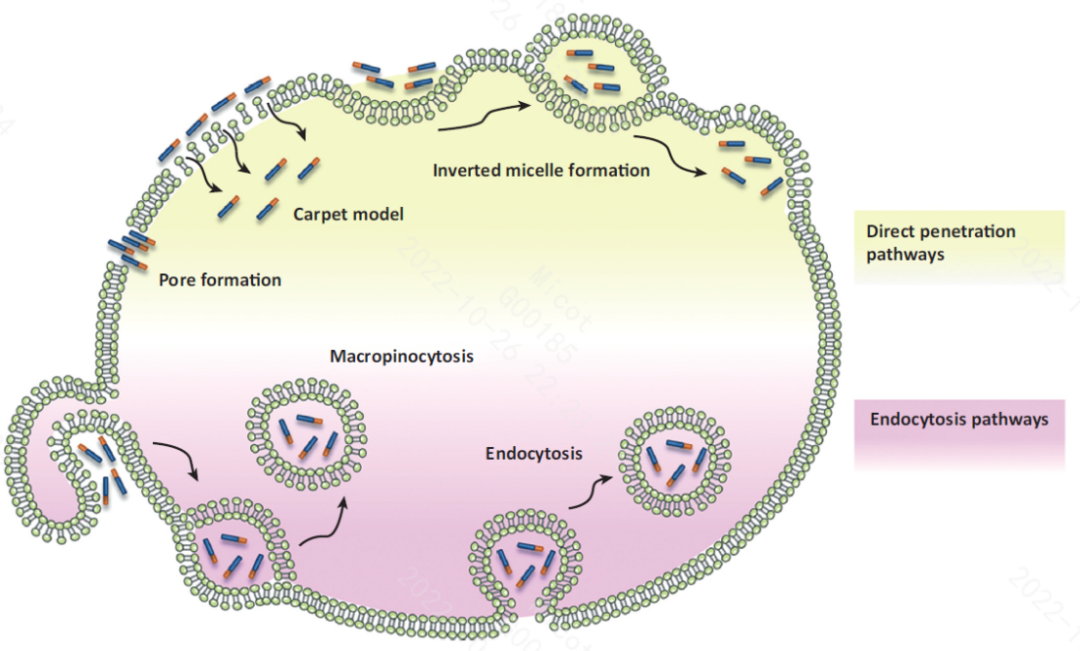
尽管已开展了大量研究,目前对于CPPs的确切透膜机制仍不是很明确。由于不同CPPs或CPPs偶联物的物理化学性质、分子大小和浓度差异较大,而这些特征对CPPs进入细胞的效率有显著影响。总体上,CPPs的透膜过程可以归为两类:非细胞质膜依赖的直接穿透(Direct penetration)和能量依赖的内吞作用(Endocytosis)。
Hossein D.et al.Trends in Pharmacological Sciences, April 2017, Vol. 38, No. 4,406.
3.1直接穿膜机制
CPPs在直接穿透细胞膜时,不依赖能量,即使在非常低的温度下也可以实现,甚至在存在内吞抑制剂的情况下也可以发生。有研究者认为CPPs首先聚积在细胞膜磷脂双层的外部,诱导膜变形并形成瞬态环形(Toroidal pores)或桶形孔状通道(Barrel-stave pores)。另外,针对阳离子型CPPs的细胞摄取研究表明,在较高pH值条件下,细胞膜上的脂肪酸与细胞外CPPs的胍基结合,再通过瞬态环形孔介导其在质膜上转运。在与pH值较低的细胞质接触时,细胞膜脂肪酸将CPPs释放到细胞中,瞬态孔关闭,实现CPPs的跨膜运输。
3.2内吞机制
尽管直接渗透机制被首先提出用于解释CPPs的透膜过程,但后续大量的研究表明,许多CPPs和CPP s偶联物主要是通过内吞机制实现跨膜运输。内吞作用是在细胞中自然发生的、依赖能量的过程。这一机制可能涉及几种不同的途径,这些途径可以分类为大胞饮作用(Macropinocytosis)、网格蛋白(Clathrin)或膜内陷素(Caveolin)介导的内吞作用、网格蛋白或膜内陷素独立内吞作用。何种途径占据主导主要取决于CPPs偶联物的结构大小和物理化学性质。虽然CPPs可以通过非内吞机制直接进入细胞质中,但有研究表明,在内吞作用期间,CPPs仍然被困在囊泡(Endocytic vesicles)中。因此,在CPPs和CPPs偶联物发生内吞之后,必须从囊泡中进入到细胞质溶液,从而避免被溶酶体降解,最终到达作用靶点发挥其生物学活性。逃离内吞囊泡似乎是功能大分子完成有效细胞内递送的主要限制因素。
CPPs从内吞囊泡逃逸的确切机制仍然不清楚,尽管有些假说已被提出用于解释此过程。例如一种观点认为,CPPs的正电荷可以与内吞囊泡的负电荷成分相互作用,这种结合会导致囊泡的破裂和内含物的释放。另一种假说认为,内吞囊泡内外pH差异导致CPPs与膜的相互作用,最终使囊泡破裂。还有一种观点认为,随着囊泡内容物的浓度升高,囊泡也会自然发生破裂,使CPPs逃逸。
目前,已经研究出了各种策略以改善CPPs偶联物的囊泡逃逸效率。其中一种方法是在CPPs中引入对pH敏感的肽序列,该pH敏感结构域在囊泡的酸性pH下破坏了膜的稳定,从而促进了CPPs从囊泡中逃逸。还有一种方法是在CPPs中插入富含组氨酸的序列,在囊泡pH条件下吸附质子,导致囊泡因渗透压增加而破裂,称为质子海绵效应(Proton-sponge effect)。
CPPs的临床应用
过去几十年中,对各种CPPs衍生疗法的临床前和临床研究结果揭示了其潜在的巨大临床应用价值。AVI4658是Sarepta Therapeutics开发的CPPs-PMO(Phosphorodiamidate morpholino oligomers)衍生药物,用于杜氏肌营养不良(Duchenne muscular dystrophy)的治疗,该药已完成了III期临床研究,于2020年被FDA批准上市;Auris Medical开发的CPPs衍生药物AM-111可谓命途多舛,其已于2018年完成的III临床研究,因试验结果未达到主要研究终点,导致开发终止;OMO-103是Peptomyc S.L开发的基于CPPs的非小细胞肺癌(NSCLC)治疗用药,目前已被批准开展I/II期临床研究;此外,还有多家制药公司开发的CPPs偶联药物进入到了临床研究阶段。

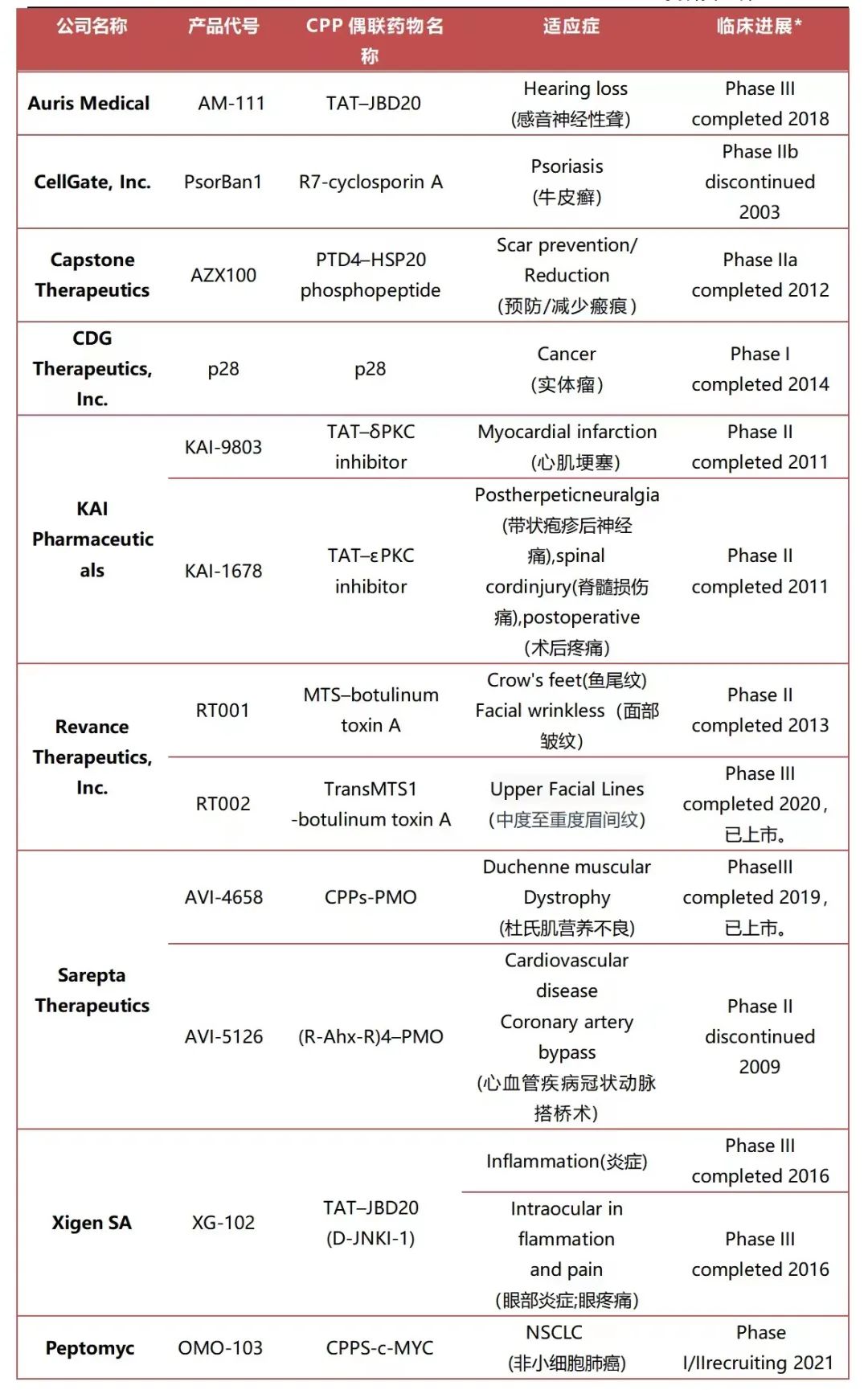
*:临床进展数据来源于药融云数据库和ClinicalTrials.gov网站。
CPPs临床应用的局限性及优化措施
尽管已有大量临床前和临床试验数据证明了CPPs在跨细胞和组织屏障中运输各类药物分子的能力,但要达到大规模临床应用还需要一系列问题需要解决:
⑴细胞、组织及器官的特异性较低;
⑵CPPs的细胞摄取机制还未研究清楚,增加了偶联物引起的毒副作用风险;
⑶尽管CPPs在由细胞外运输进入细胞的过程5~30min内就可以完成,但部分CPPs在此过程中还是容易被蛋白酶水解;
⑷将质粒DNA转运至细胞内仍然有相当大的挑战。
基于以上分析, CPPs衍生药物如果要得到较好的临床应用,需要在以下多个方面开展更为深入的研究:
⑴对细胞摄取机制深入研究,探索不同CPPs和细胞类型、偶联物性质之间的关系,利用这些参数对最佳组合条件进行理论预测;
⑵开发有效的定位序列,将穿膜肽和定位肽融合得到“双功能CPPs”,提高CPPs的细胞和组织特异性;
⑶优化CPPs跨膜运输质粒DNA的效率,发掘CPPs在基因疗法中的应用潜力;
⑷将CPPs嵌合至多功能聚合物或纳米脂质体载体中,提高偶联物运输的选择性、效率、能力,尤其是进入癌细胞的能力;
⑸使用荧光标记的CPPs或纳米载体,提高对肿瘤疾病发生和转移的诊断和研究效率;
⑹将CPPs与抗体、酶及其它大的功能蛋白偶联并运送至细胞内,开发更加令人振奋的治疗方法。
小结和展望
自1988年从HIV-1转录蛋白中发现了CPPs以来,过去数十年,相关研究初步揭示了其跨细胞膜运输机制的神秘面纱。CPPs是新药研究和开发中一种非常有用的工具,可以携带多种不同大小和性质的生物活性物质进入细胞,包括小分子化合物、染料、多肽、肽核酸(Peptide Nucleic Acid, PNA)、蛋白质、质粒DNA、siRNA、脂质体、噬菌体颗粒等,这一性质为其成为靶向药物的良好载体提供了可能。大量基于CPPs衍生物疗法的临床前和临床研究结果展示了其在肿瘤、心脑血管、疼痛、神经系统等疾病治疗方面巨大的临床应用价值。虽然在细胞特异性、细胞转导效率等方面还存在一定的局限性,但和其它新兴治疗手段的发展历史类似,随着功效机制逐渐阐明和技术手段的不断进步,相信基于CPPs衍生药物的治疗技术一定会大放异彩,为大量新药的设计与开发提供更多的思路和选择。
References
[1]Richard Daneman.et al.The Blood–Brain Barrier.Cold Spring Harb Perspect Biol 2015;7.
[2]Giulia Guidotti.et al.Cell-Penetrating Peptides:From Basic Research to Clinics.Trends in Pharmacological Sciences, April 2017,Vol.38,No.4.
[3]Jian Song.et al.Cyclic Cell-Penetrating Peptides with Single Hydrophobic Groups. ChemBioChem 2019, 20, 2085 – 2088.
[4] Meng Wang.et al. Cellular RelB interacts with the transactivator Tat and enhance HIV‑1
expression.Retrovirology (2018) 15:65.
[5]Vivès, E. et al. A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus.J.Biol.Chem.1997,272,16010–16017.
[6]Siegmund Reissmann.et al.Cell penetration: scope and limitations by the application of cell-penetrating peptides.J. Pept.Sci.2014;20:760–784.
[7]Hossein Derakhshankhah.et al. Cell penetrating peptides: A concise review with emphasis on biomedical applications. Trends in Pharmacological Sciences, April 2017, Vol. 38, No. 4,406–424.
[8]S.Jafari,E.Ahmadian.et al.Biomacromolecule based nanoscaffolds for cell therapy.J. Drug Deliv. Sci. Technol. 37 (2017) 61–66.
[9]B. Angelov.et al.Multicompartment lipid cubic nanoparticles with high protein upload: millisecond dynamics of formation,ACS Nano 8 (5) (2014) 5216–5226.
[10]A.Angelova.et al.Neurotrophin delivery using nanotechnology,Drug Discov Today 18 (23-24) (2013) 1263–1271.
[11]Special Issue “Delivery of therapeutic molecules-from benchto bedside”.Biochimica et Biophysica Acta (BBA) Biomembranes 2010;1798(12): 2177–2314.
[12]P.Rangadurai,M.R.Molla,P.Prasad,M.Caissy,S.Thayumanavan,Temporal and triggered evolution of host–guest characteristics in amphiphilic polymer assemblies.J. Am. Chem. Soc. 138 (24) (2016) 7508–7511.
[13]Chérine Bechara.et al.Cell-penetrating peptides:20 years later,where do we stand? FEBS Letters 587 (2013)1693–1702.
[14]Jing Xie.et al.Cell-Penetrating Peptides in Diagnosis and Treatment of Human Diseases: From Preclinical Research to Clinical Application.Frontiers in PharmacologyMay 2020,Volume 11,Article 697.
[15] Violini, S. et al. Evidence for a plasma membranemediated permeability barrier to Tat basic domain in welldifferentiated epithelial cells: lack of correlation with heparin sulfate.
Biochemistry .2002,41, 12652–12661.
[16]Mueller,J.et al.Comparison of cellular uptake using 22 CPPs in 4 different cell lines. Bioconjug. Chem. 2008,19, 2363–2374.
[17]Hirose,H.et al.Transient focal membrane deformation induced by arginine-rich peptides leads to their direct penetration into cells. Mol.Ther.2012,20,984–993.
[18]Koppelhus,U.et al.Cell-dependent differential cellular uptake of PNA, peptides, and PNA–peptide conjugates.Antisense Nucleic Acid Drug Dev.2002,12, 51–63.
[19]Aguilera,T.A.et al. Systemic in vivo distribution of activatable cell penetrating peptides is superior to that of cell penetrating peptides.Integr.Biol.(Camb.).2009,1,371–381.
[20]Olson,E.S.et al.In vivo characterization of activatable cellpenetrating peptides for targeting protease activity in cancer.Integr.Biol.(Camb.)2009,1,382–393.
[21]Varkouhi,A.K.et al.Endosomal escape pathways for delivery of biologicals.J.Control. Release.2011,151, 220–228.
[22] Peptide Institute. Peptomyc:Cell-penetrating peptide OMO-103 approved for phase I/II clinical trials.2022.
[23]Agrawal,P.et al.Gautam,A.CPP site 2.0:A repository of experimentally validated cell-penetrating peptides. Nucleic Acids Res. 2016, 44, 1098–1103.

作者简介:
郭超,麦科奥特原料药部高级经理,负责麦科奥特苏州原料药部多肽产品开发相关工作。
麦科奥特原创文章,转载请联系后台

 企业邮箱
企业邮箱 企业OA
企业OA