随着与多肽合成相关的技术(如固相/液相合成技术)、设备和工艺、化合物设计、筛选等方面的迅速发展,多肽药物研发成本和生产成本大幅下降,促使多肽药物的开发持续升温。
特别近两年,两款代表性的双功能多肽药物Apellis的Pegcetacoplan (APL-2)和Lily的Tirzepatide(替西帕肽) 的成功上市,标志着多功能肽的商业化正式拉开了帷幕。
01多肽药物背景简介
1.1 多肽定义和特点
肽是α-氨基酸以肽键连接在一起而形成的化合物,分子量一般在10 kDa以下。通常由10-100个氨基酸分子组成,其与蛋白质并没有明确的界限。
FDA将术语“蛋白质(protein)”解释为“具有明确定义的序列且大于40个氨基酸的任何α-氨基酸聚合物”,属于生物制品许可申请(BLA),小于等于40个氨基酸的多肽药物研发仍可参考小分子的监管要求。
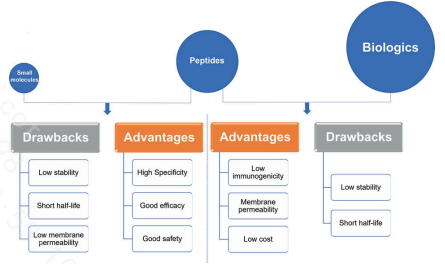
多肽药物分子介于生物大分子和小分子化药之间,具有如下一些特点:
①具有较高的安全性和较高的靶标亲和力。
②大多数以内源性多肽为模板(多数为各种激素),脱靶风险小。
③多肽化学合成技术成熟,成本降低,并且容易引入非天然氨基酸等进行改造;且容易与杂质或副产品分离,纯度高。
④相对较低的免疫原性。
⑤从统计数据来看,多肽药通过临床试验批准上市概率比小分子药高出2倍。
1.2 多肽药物发展历程
1922年胰岛素最早进入临床,直至1963年多肽固相合成技术出现之前,多肽药物发展缓慢。进入20世纪70年代以后,越来越多的多肽药物进入临床或成功上市。比较有代表性的多肽药物如奥曲肽、亮丙瑞林、格拉替雷、特立帕肽、利拉鲁肽、利那洛肽、度拉糖肽、索马鲁肽等等。
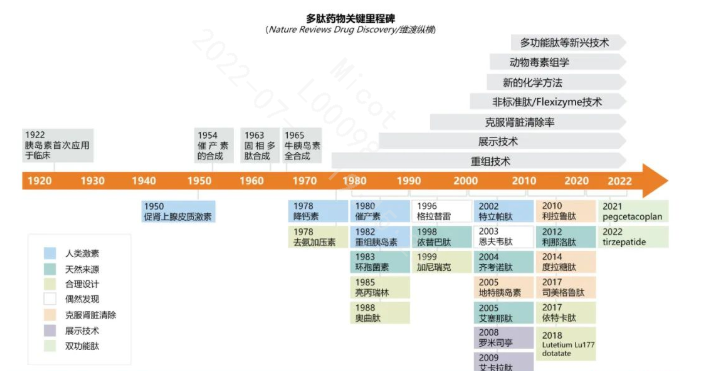
总体来看,随着各种先进技术的出现,2000年以后,天然多肽不断丰富,特别是来自毒液中的多肽组学以及新的化学修饰方法推进了新型多肽药物的发现,例如多功能肽、约束肽、偶联肽、口服肽以及长效化、递送系统等新兴技术的出现,大大推动了多肽药物领域的繁荣发展。
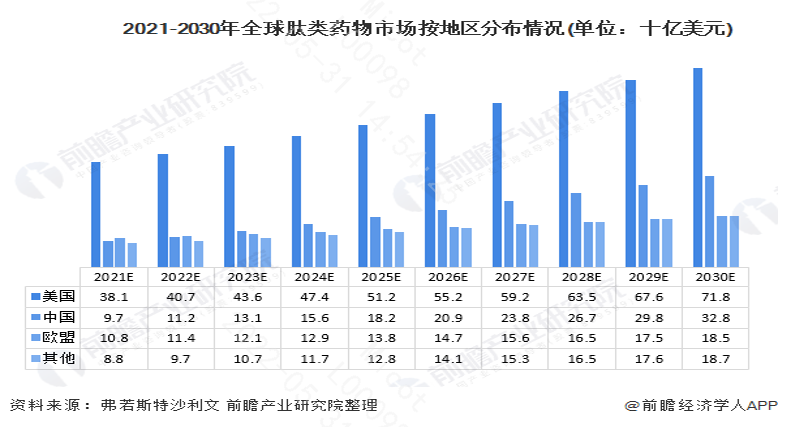
到目前为止,全球已经有80多种多肽类药物获批上市,市场规模从2016年的568亿美元上升至2020年的628亿美元。预计全球市场规模于2030年将达到1419亿美元。
截止到2021年,礼来的度拉糖肽年销售额达到67.5亿美元;紧随其后的是2018年上市的索马鲁肽,有了亮眼的临床数据背书,索马鲁肽销售额正处于急速上升期;据统计,2022年上半年索马鲁肽销售额已经超越了度拉糖肽。其他的多肽药物也均有不俗的销售业绩。
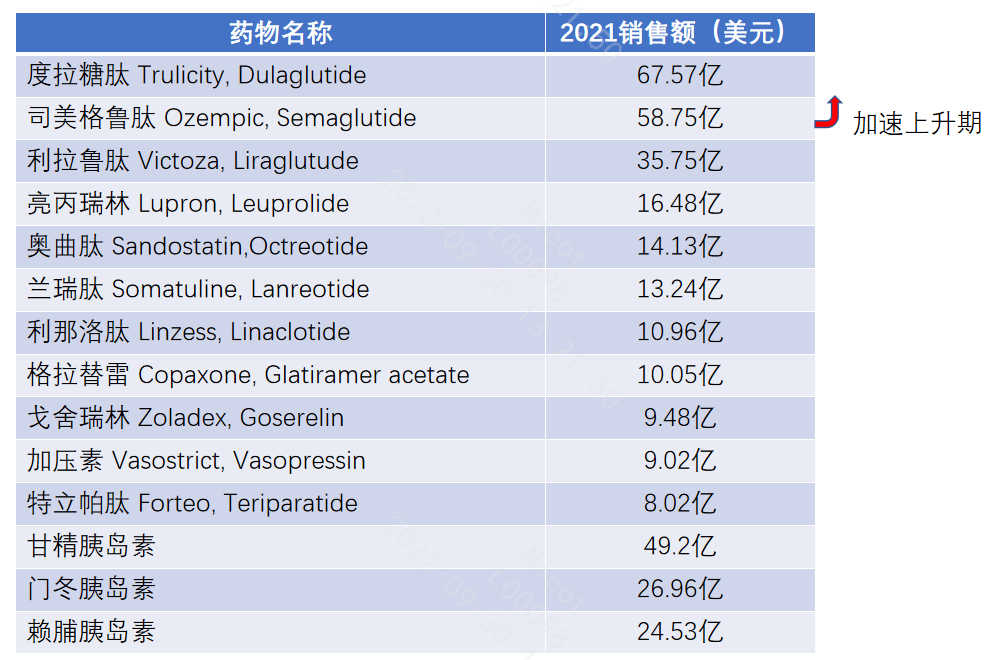
经典多肽产业,目前主要由国外大型制药厂主宰,如NovoNordisk (诺和诺德)、Novartis (诺华)、AstraZeneca (阿斯利康)、Eli Lilly (礼来)、Takeda (武田)、Amgen (安进)、Ferring (辉凌制药)等;中国经典多肽产业主要包括前沿生物、恒瑞、豪森、仁会生物,多肽仿制药公司翰宇药业、信立泰等。目前国产上市多肽新药数量仅3款,分别是豪森药业的聚乙二醇洛塞那肽、前沿生物的艾博韦泰、仁会生物的贝那鲁肽,但是市场占比仍然较小。
多肽药物发展方向
2.1多肽药物发展特点
随着多肽药物研发技术(化学合成,基因发酵,展示技术,计算辅助)的不断进步,多肽分子结构也发生了一定的变化,例如肽序列平均长度在逐渐增加;多肽药物分子的组合形式也更加多样化。从最初的全部天然氨基酸到引入D构型氨基酸或其他非天然氨基酸;并且逐渐拓展到脂肪酸修饰、PEG修饰,与多肽偶联,与蛋白偶联,与小分子偶联,或与其他功能集团偶联。

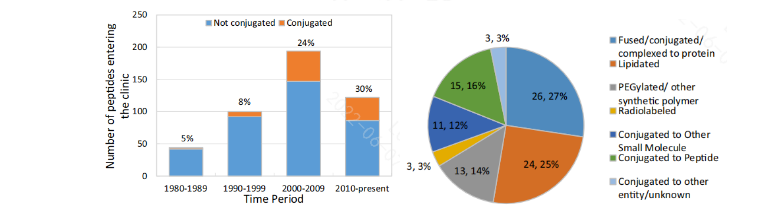
2.2 多肽药物分类
当前多肽药物(含在研)主要分以下几类:

2.2.1约束肽
由于链状多肽的弹性比较大,可以任意的扭曲和翻转,通过引入环状结构,提高多肽的稳定性,降低可能的一些副作用,使之具有更好的成药性。
约束肽有多种形式,常见的包括单环肽(酰胺键,二硫键)、订书肽、双环肽等。
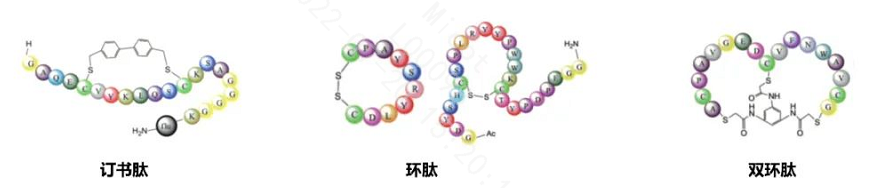
约束肽的典型代表是2021年刚上市的Pegcetacoplan(APL-2),下文会有简单的介绍。
2.2.2 偶联肽
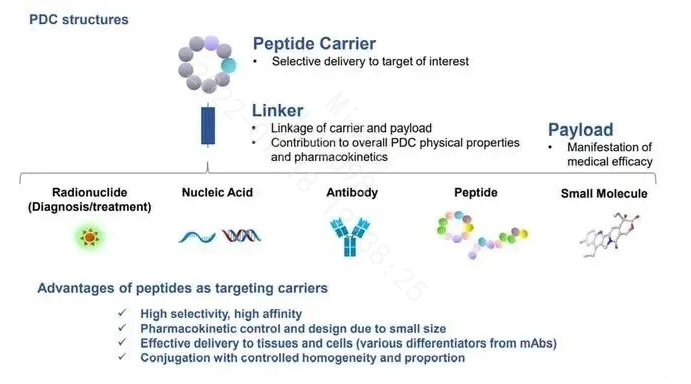
多肽CRO公司“PeptiDream”将多肽偶联药物的概念进行了拓展,即广义的多肽偶联药物:泛指那些与抗体(PAC,Peptide Antibody Conjugate)、核酸 (POC,Peptide Oligonucleotide Conjugate)、多肽 (多功能肽)、核素 (RDC,Radionuclide Drug Conjugates)、小分子 (PDC,peptide drug conjugate)等偶联的多肽药物,统称为“偶联肽”。
其中从查询到的信息可以看到,麦科奥特开发的多功能Peptibody,开创了国内的先河。期待其在相关适应症领域的研究结果。
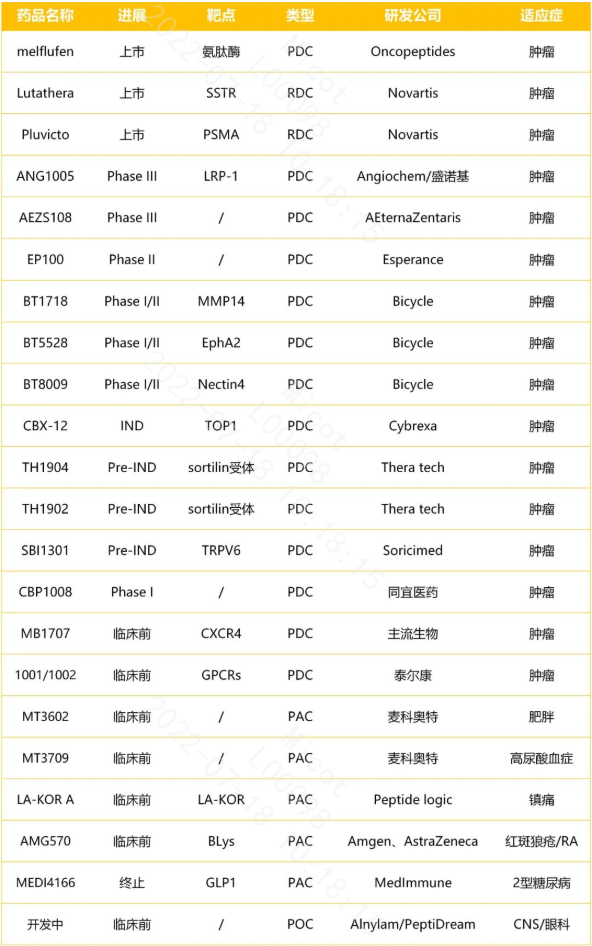
2.2.3 口服肽
近年来对促进多肽口服吸收的研究在临床前和临床试验方面取得较大进展。
2019 年,诺和诺德和Emisphere Technologies合作开发的口服索马鲁肽获批上市,成为口服肽领域重大里程碑。
目前仅有4款口服多肽药物上市,分别是治疗便秘的胶囊剂利那洛肽和普卡那肽、治疗糖尿病的索马鲁肽/司美格鲁肽、治疗肢端肥大症的奥曲肽。但是利那洛肽和普卡那肽在肠胃道中就会发挥作用,并不经过吸收,因此真正意义上的口服多肽药物也就索马鲁肽和奥曲肽。
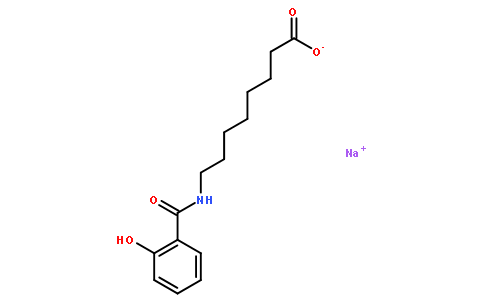
索马鲁肽的口服是借助于SNAC小分子(一种化学合成的水杨酸乙酰氨基酸衍生物),用它解决了肠溶、防酶解和促渗透等问题。然而,口服索马鲁肽生物利用度依然很低,只有1-2%左右,因此口服剂量远远高于注射剂,成本增加;同时口服前需空腹6小时、用药后还要空腹半小时,用药不够便利,导致2020 H1口服索马鲁肽只实现5240万美元收入,而同期注射索马鲁肽的销售额是14.2亿美元,相差悬殊。
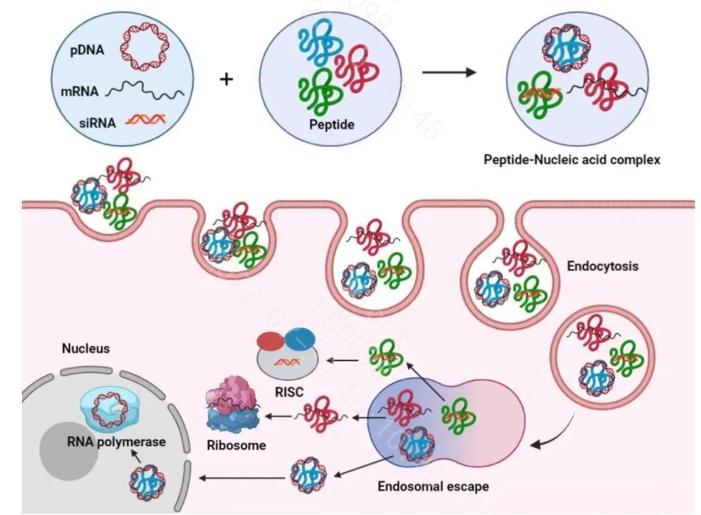
2.2.4 多肽基因载体
这一类多肽含有多个赖氨酸或精氨酸残基,它们在生理pH值下带有正电荷,通过静电相互作用与核酸结合,然后与细胞膜相互作用,并进入细胞。目前为止还没有上市的药物出现。
2.2.5 多肽疫苗
肿瘤治疗性多肽疫苗:找到肿瘤细胞中特异的新抗原,并以此氨基酸序列开发癌症疫苗,能够激活相关免疫细胞杀伤具有相同抗原的肿瘤细胞。
预防性多肽疫苗:德国蒂宾根大学领衔设计的一款名为CoVac-1的多肽新冠疫苗,在I期临床试验中展现出了良好的安全性、反应原性和免疫原性,并且对目前的各种突变株均有良好的保护效果。目前,针对该疫苗的II期临床试验正在开展。
2.2.6 多功能肽
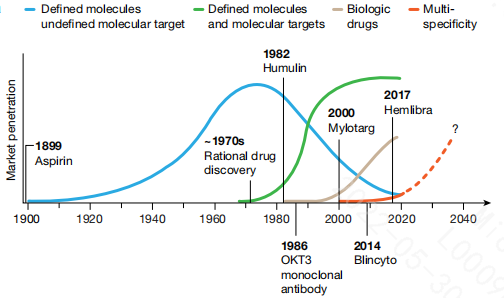
提到多功能肽,就不得不提制药工业发展的四次革命性浪潮。
第一次革命性浪潮,即现代制药工业的起源,20世纪初,以经验主义的代表“神药”阿司匹林为标志,即只知道它可以抗炎镇痛,但是并不知道机理。
第二次革命性浪潮,从20世纪70年代开始,以理性药物发现方法学(1T1D- One Target One Drug)取代经典的经验药理学为标志,即先明确一个靶点,然后针对该靶点进行药物设计和筛选。
第三次革命性浪潮,从20世纪80年代开始,以基于重组蛋白的治疗药物(生物药)为标志。
第四次革命性浪潮,从21世纪起始,即多特异性药物的出现。虽然到2020年为止,只有四种前瞻性设计开发的多特异性药物被批准,但这波浪潮正在迅速形成。
03 双功能肽发展现状与展望
双/多功能肽——两种或两种以上多肽序列偶合(通过不同形式的组合),具有靶向多个靶点、具备多种药理活性、形成不同机制间的协同增效和具备更好安全性的多肽分子。
一些复杂疾病如心脑血管、代谢、中枢神经系统及免疫性疾病等, 由于其复杂的发病机制, 如果按照单靶点药物“一种疾病, 一个靶点, 一种治疗药物”的常规模式, 往往容易达不到理想效果。
与此相对,双功能肽(药物)就会具备以下优点:
1.不同信号传导机制同时作用,显著提高成药性和适应症的有效性,最大化生物活性效应,并呈现更平衡的PK行为,降低副作用。
2.结合现有的靶点,许多多肽分子已经过临床验证,在这个基础上可以通过创造性地发现更好的组合形式,以寻求更好的药物。
3.就涉及的风险和成本而言,多功能肽与其他单一分子实体在临床开发中,原则上没有区别。
4.多功能肽与鸡尾酒或多组分药物相比,无复杂药物-药物相互作用,避免单药联合用药产生的复杂PK/PD行为,风险更低,患者和医生依从性更好。
3.1双功能肽的组合形式
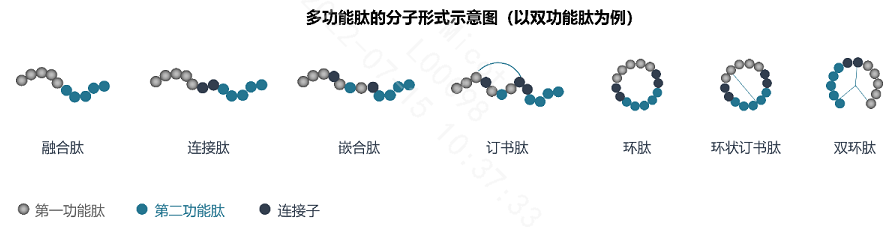
3.1.1 连接(肽)
Conjugate缀合/连接:通过设计引入一种连接子(Linker),实现其代谢中释放两个配体,与每个靶标独立相互作用。
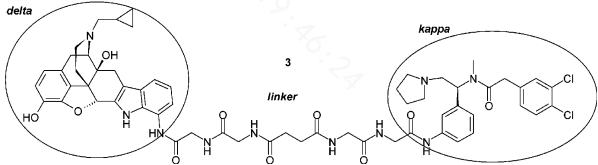
例如以上两个阿片配体经linker连接,与它们的单体相比,具有更大的效力和选择性。
3.1.2 融合(肽)
Fused融合:随着linker尺寸的减小,直至可直接偶联,视为“融合”。
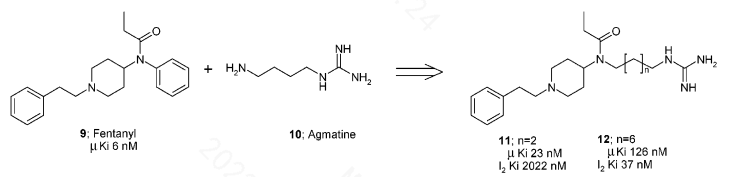
例如以上分子,通过调节碳链的长度,最终在8个碳间隔的化合物具有相对最好的活性平衡。已经处于临床阶段的MT1013和MT1009等属于融合肽。
3.1.3 嵌合(肽)
Merged嵌合:通过利用两个目标化合物结构中的共性来达到合并的目的。
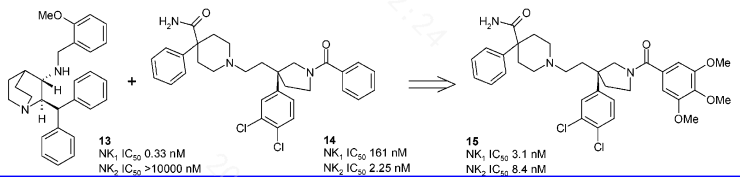
例如以上分子,针对同一病症的NK1/NK2双配体,根据结构上的共性,优化达到活性平衡的目的。最具代表性的嵌合肽就是刚获批上市的替西帕肽。
3.1.4 双环肽
Bicycle Therapeutics利用噬菌体筛选平台筛选出的靶向肽,设计成Bicycle,它是由短的线形肽在“支架”的作用下形成两个环的短肽(9~15个氨基酸组成),其分子量在1.5~2KDa,具有良好的组织渗透率和肾脏清除率、高度亲和力和选择性的优点。并且在此基础上能够设计更多的组合形式。
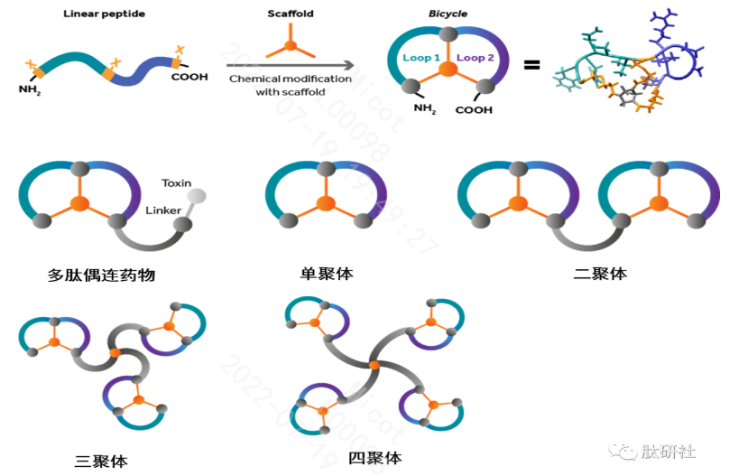
3.2双/多功能肽设计策略
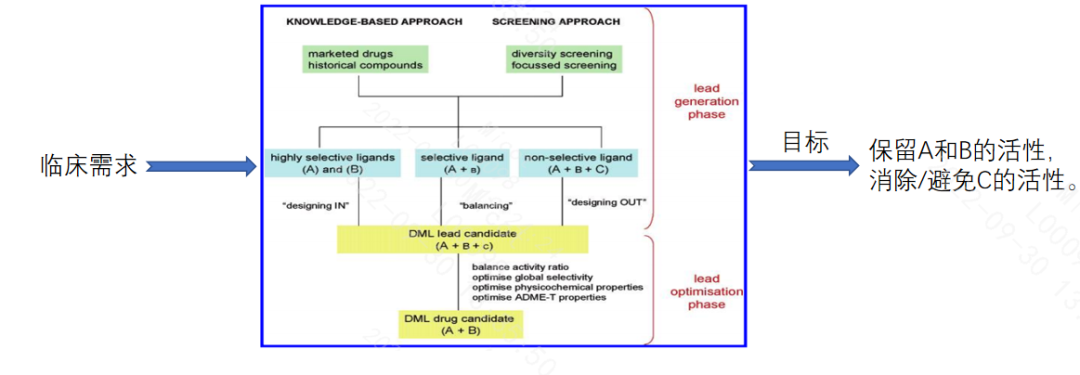
基于双功能肽的结构和成药性特点,一般的设计策略如下:
1.基于已有知识/经验,设计一系列的起始化合物,进行筛选。
2.这些起始化合物可能具有高选择性、中等选择性(在第二个目标上很少或没有活性)或非选择性(具有不期望的活性)。
3.按照高选择性的“设计入”、中等选择性的“平衡”改造、出现不期望活性的“设计出”的策略,进行多轮的筛选。
4.最终实现平衡活性比,优化选择性,优化理化性质,特别是优化吸附、分布、代谢、排泄和毒性(ADME-T)。
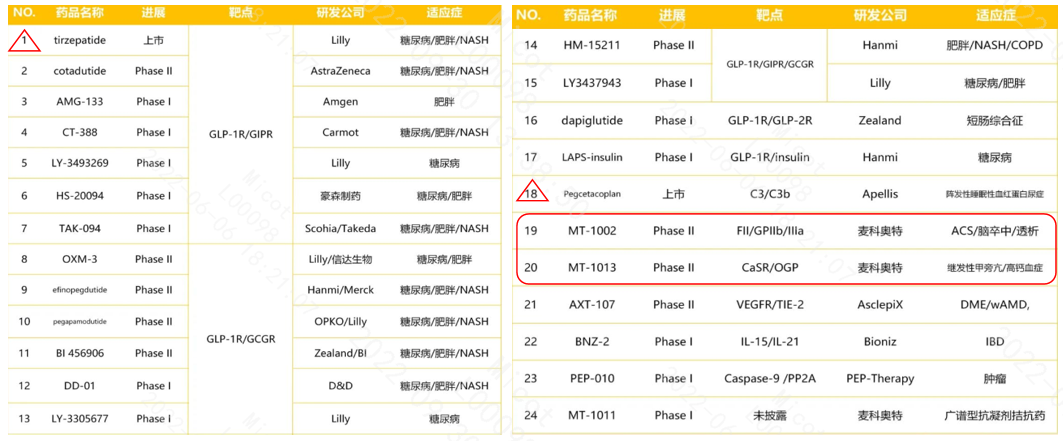
3.3双/多功能肽药物临床情况
全球进入临床阶段 (含2个上市)的多功能肽约24个。最具代表性的多功能肽龙头企业包括Eli Lilly (礼来)、Apellis、Hammi、AstraZeneca (阿斯利康)、Amgen (安进)等,国内就麦科奥特一家。
统计显示,全球大药厂的双功能肽和三功能肽基本集中于糖尿病、肥胖和NASH,适应症选择竞争激烈;仅有Apellis、麦科奥特、Bioniz另辟蹊径,形成差异化的旗帜,将多功能肽推向不同治疗领域。
3.4 双功能肽的典型代表
随着Pegcetacoplan和Tirzepatide的获批上市而正式被世人所熟知,成为多肽新经济的典型代表。
3.4.1 首款上市的双靶点多肽药物Pegcetacoplan
Pegcetacoplan (APL-2),Apellis开发的靶向近端补体蛋白C3家族的聚乙二醇化环状双功能连接肽,可特异性地结合C3和C3b补体,抑制血管内和血管外溶血。临床数据甚至优于Alexion的SolirisC5抑制剂(其2019-2021年Soliris销售39.46/40.64/10亿美元)。
同时Apellis也在评估APL-2在血液、眼科、肾脏病和神经系统等多个领域治疗潜力。Pegcetacoplan是通过Phage Display筛选而来,经优化形成了最早的先导化合物APL-1。
同时,为了延长药物半衰期,将两个APL-1环肽通过PEG连接后最终形成了Pegcetacoplan(APL-2)。将半衰期延长至一周左右,最终使患者仅需每2周皮下注射一次,显著提升了患者依从性。未来势必会对SolirisC5形成较大冲击。

3.4.2第二款上市的双靶点多肽药物Tirzepatide
Tirzepatide(替西帕肽) 是首个也是目前唯一一个FDA批准的GIP/GLP-1双受体激动剂。它将两种肠促胰岛素的作用整合到一个分子中,实现了每周一次的双重葡萄糖依赖性降糖效果。
Tirzepatide在2型糖尿病头对头3期SURPASS-2临床试验的40周结果中,与诺和诺德注射用司美格鲁肽相比,在降低血糖(A1C)和体重方面均显示出了一定的优越性。在研的适应症包括肥胖、心血管风险相关疾病、心力衰竭、非酒精性脂肪肝炎。
礼来的Tirzepatide获FDA批准:标志着双功能肽药物开发进入黄金时代。业界分析,Tirzepatide有望成为礼来继度拉糖肽后,糖尿病市场又一个王牌产品,分析师目前预计Tirzepatide 2023年的销售额将超过10亿美元,到2030年底将达到175亿美元。在uate Pharma发布的2021年最有价值TOP10研发项目报告中,Tirzepatide也以187亿美元的净现值位居第一。
3.4.3GLP-1R/GIPR/GCGR代表性双/多功能肽的竞争格局
虽然糖尿病的市场很大,但是竞争也是格外激烈。特别是随着索马鲁肽和替西帕肽这两款在控糖降重方面都表现十分优异的新药上市的情况下,其他在研药物想单纯在这方面展现更好的临床效果将会变得更加困难。因此差异化优势将是一个突破口。
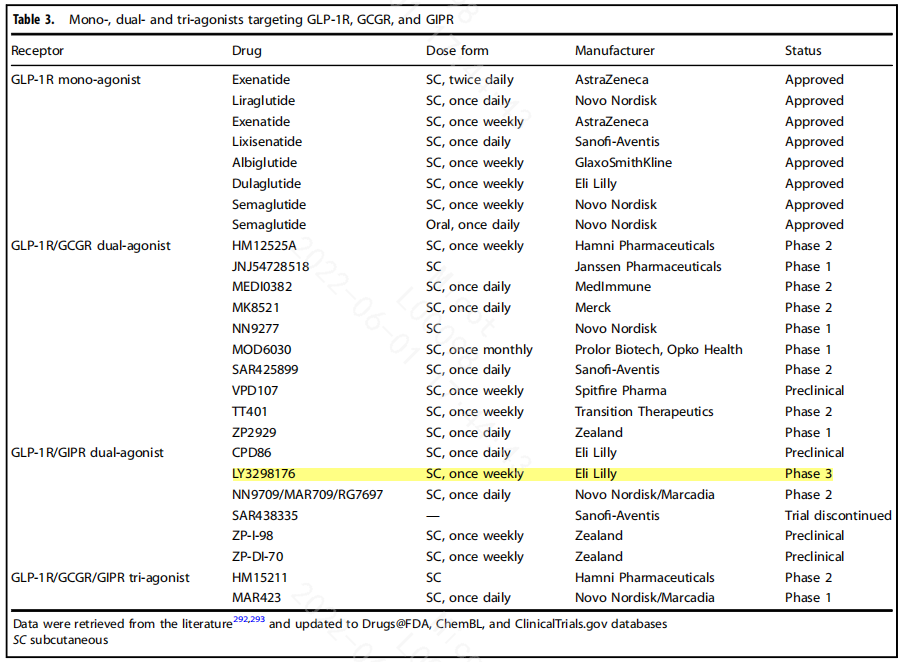
上表中可以看到,HM12525A 强生已终止与韩美协议,TT401礼来已终止合作,NN9709临床已终止;MEDI0382降低肝脏脂肪水平和减轻肝纤维化的效果;韩美HM15211非酒精性脂肪性肝炎候选药物获得FDA孤儿药称号,用于治疗原发性硬化性胆管炎;IBI362(LY3305677)GLP-1R和GCGR双重激动剂分子,由信达生物和礼来(Eli Lilly and Company)共同推进其在中国的开发和商业化。
3.4.4GLP-1/GIP/GCG分子结构分析
越来越多的研究表明,GIPR/GLP-1R的双重激动剂和GIPR/GLP-1R/GCGR的三重激动剂在体内外显示出比单激动剂更为优越的药效结果。
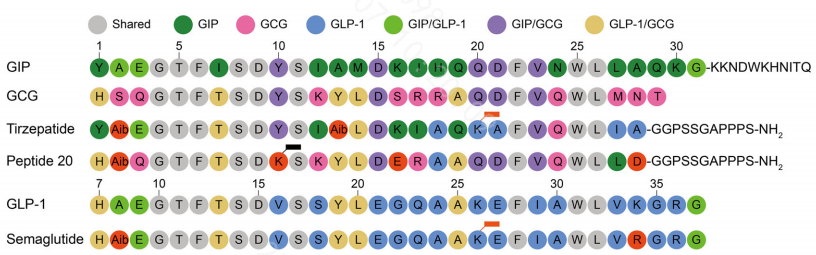
从分子结构上看,GLP-1/GIP/GCG存在一定的相同序列,这也就为设计双/三功能于一个肽分子中,创造了结构基础。文献中报道Peptide 20分子(GIPR/GLP-1R/GCGR三重激动剂)在糖尿病大鼠模型中能显著降低体重和糖化血红蛋白。
研究也发现Tirzepatide和Peptide 20均显著改变了GIPR的ECL1构象,而不影响GLP-1R或GCGR的ECL1构象,推测GIPR可能是多重激动剂发挥疗效的关键因素。
胰高血糖素不再被视为单一的升血糖剂,因为胰高血糖素对β细胞的促胰岛素作用可以降低血糖。有鉴于此,α细胞中的GIPR通过胰高血糖素分泌促进的α-β细胞通讯诱导更大的胰岛素分泌,而不仅仅只是通过β细胞中的GIPR。虽然GIP生物学的一些早期理论正在被颠覆,但GIP的活性对体重的贡献仍然存在争议。事实上,这场辩论的双方都有越来越多的证据表明,GIPR的激活或者抑制都可以减肥和降重。
3.5 双/多功能肽药物总结与展望
3.5.1递送技术
据统计,>90%的临床开发阶段的肽,靶向细胞外靶点,大部分多肽膜不渗透、无法靶向细胞内靶点,从而限制了其在药物开发中的应用。具备穿膜功能的脂质纳米粒LPN或者穿膜肽将有可能被更加重视。
3.5.2分子设计-复杂性
多肽的分子结构越来越复杂,是一个重要的发展趋势,不仅仅表现在引入非天然氨基酸,或其他更多的功能集团(蛋白、小分子)等;还包括更多组合形式,环肽、双环肽,订书肽,β折叠等。

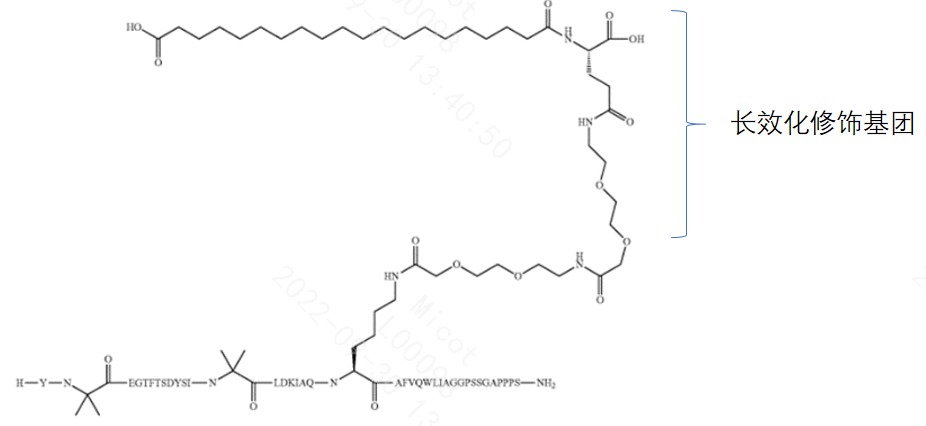
由于氨基酸本身的局限性,多肽在体内往往存在半衰期短/稳定性差的问题,溶解性、长效化修饰是经常要被考虑到的问题。例如下图所示分子在设计实现双功能的同时,已经兼顾进行了长效化改造。
3.5.3 肽筛选技术和计算生物学
肽筛选技术,如噬菌体展示,mRNA展示等新技术的出现,为在短时间内开发出高效、有选择性的先导肽提供了可靠的途径。
同时借助计算工具可以快速搜索结合位点的共性,有助于预测/开发那些相似靶点的多功能肽,支持多肽新分子实体的发现。
4.总结
双功能肽并不是简单地从框架上合并目标分子,而是需要在药效团水平上进行不断的设计和优化。因为不同配体的合并,往往会引起整体分子结构的复杂化,因此需要合理改造分子结构。
需要指出的是,对于高度不同的靶点,实现多种活性在一个紧凑的分子中,被证明是不可能的或者说难以成药的。因为针对高度不同的靶点,调整活性的比率要困难得多,同时不同疾病严重程度和不同患者之间相对代谢率的差异,导致这样的候选药物反而不如单一疗法的组合,因为后者根据实际情况剂量更灵活。
因此双功能只有针对相似靶点或同一适应症的不同靶点,合理设计药物,协同发挥作用才更容易实现,效果也会越好。
系统性地发现双/多功能肽是一个新领域,充满着机会和挑战。
伴随着双功能肽Pegcetacoplan和Tirzepatide连续获批上市,多肽新经济产业必将成为资本的新焦点,那些具备源头技术创新平台、解决真正临床未满足需求的全球化多肽新经济企业将脱颖而出。

参考文献
1.Nature Reviews volume 20,April 2021,309-325;10.1038/s41573-020-00135-8
2.全球多肽新经济研究报告-凯莱英Asymchem
3.J.L. Lau, M.K. Dunn / Bioorganic & Medicinal Chemistry 26 (2018) 2700-2707;10.1016/j.bmc.2017.06.052
4.Nature,Vol 580,16 April 2020,329-338;10.1038/s41586-020-2168-1
5.Journal of Medicinal Chemistry, 2005, Vol. 48, No. 21 6523-6543;10.1021/jm058225d
6.https://xueqiu.com/1222332425/147320501
7.Signal Transduction and Targeted Therapy (2021) 6:7;10.1038/s41392-020-00435-w
8.NATURE COMMUNICATIONS | (2022) 13:1057;10.1038/s41467-022-28683-0
9.Signal Transduction and Targeted Therapy (2022) 7:48;10.1038/s41392-022-00904-4
10.Angew. Chem. Int. Ed. 2004, 43, 2109-2112;
10.1002/anie.200353242
11.NATURE COMMUNICATIONS | 8:16092;10.1038/ncomms16092

 企业邮箱
企业邮箱 企业OA
企业OA