天然存在的大部分蛋白质需要在表达后进行复杂的翻译后修饰,如糖基化,才可以发挥其正确的生物学功能。原核表达系统由于基因组简单,不能表达翻译后修饰所需的酶。而真核表达系统可以进行复杂的翻译后修饰,可以表达分泌复杂的蛋白质。真核表达系统包括酵母系统、昆虫杆状病毒系统、植物细胞以及哺乳动物细胞等类型。真核表达系统的具体划分见图1。
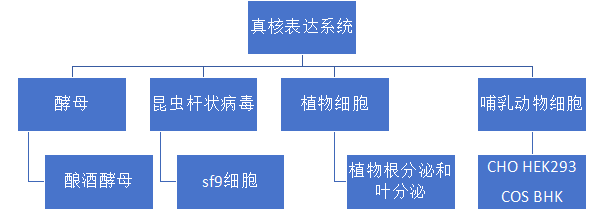
图1.真核表达系统
酵母表达系统代表性的类型有酿酒酵母、甲醇酵母等。酵母表达系统具有原核表达系统和真核表达系统的优点,具有翻译后糖基化机制接近高等真核生物,易实现高密发酵,经济、快速、产量高等优点;其缺点是表达的蛋白质糖基化与人源糖基化有较大差异,如甘露糖修饰比例高。一般用来表达细胞因子、小分子类蛋白、酶类等相关产品。酵母表达系统发酵密度高时,酵母的蛋白酶能够降解表达的目的蛋白,引起目的蛋白C端或N端氨基酸降解,因此用于该系统生产的相关产品对于产品完整性的检测至关重要。
1983年人类首次构建杆状病毒载体并成功表达了β-干扰素蛋白,此后,杆状病毒表达载体(baculovirus expression vector, BEV)系统在生产重组病毒、表达重组蛋白、提高重组蛋白稳定性、产量及翻译后修饰等方面不断优化,使得昆虫细胞-BEV系统成为四大常用表达系统之一[1]。
目前已被广泛应用到药物研发,疫苗生产,重组病毒杀虫剂等领域。昆虫表达系统组蛋白具有完整的生物学功能,如蛋白的正确折叠、二硫键的搭配,具有蛋白翻译后的加工修饰;可同时在一个载体上表达多种蛋白,并且可容纳大片段外源DNA而成为表达大片段DNA的理想载体。该病毒具有极好的安全性,外源基因插入多角体蛋白基因座位后将引起后者的缺失或失活,这样重组病毒就不会形成多角体蛋白,使得病毒粒子缺少天然的保护物,故重组病毒在天然环境下极易失活,不会造成对人类的危害和环境的污染[2]。
与哺乳动物细胞表达系统相比,昆虫杆状病毒表达系统周期相对较短。昆虫杆状病毒表达系统载体的构建主要是针对杆状病毒,而非昆虫细胞系本身,大大缩短了从基因克隆到蛋白表达的时间,目前Gibco ExpiSf 表达系统已研究出化学成分确定的培养基,并且开发出快速制备蛋白的6-10周期的工艺流程,缩短了病毒扩增的过程。
以植物细胞作为转化受体,不仅能把一些植物基因或DNA片段作为外源基因转化到受体植物,而且能把动物或微生物中存在的基因转化并整合到植物基因组中,使其在植物细胞中表达。导入植物受体细胞转化方法可分为直接基因转移和间接基因转移,直接基因转移包括电激法、基因枪法、超声波法、真空渗入法、PEG法、磷酸共沉淀法、微注射法、脂质体介导法等;间接转移法有农杆菌、病毒载体介导基因转移,其中农杆菌转化法在遗传转化中应用最为广泛,一般转化的目的基因包括各种抗虫、抗病、抗除草剂、保鲜、改善品质等基因,用于农业及花色等方面的改善。
哺乳动物细胞表达系统适合表达糖基化蛋白和空间结构较复杂的蛋白质,表达产物一般存在于细胞质中。但是通常在基因构建时在目的蛋白前加一段信号肽,使表达产物会分泌到细胞外。哺乳动物细胞具有较好的翻译后修饰系统,表达的蛋白生物学活性更加接近天然蛋白。常用的哺乳动物细胞中,仓鼠细胞有CHO,BHK等,人类细胞包含293、HT-1080、HuH-7等,老鼠细胞常用NS0和Sp2/0等,其中,CHO细胞表达体系已经成为生物制药最重要的表达系统。
CHO细胞,即中国仓鼠卵巢细胞(Chinese Hamster Ovary Cell)。它最先开始于1956年,美国科罗拉多大学Theodore T.Puck和同事Fa-Ten Kao通过一成年雌性中围仓鼠卵巢中出了永生化的成纤维细胞CHO原始细胞系,1957年从原始细胞系的一个亚克隆得到了CHO-K1细胞系,这是一上皮贴壁生长型细胞,培育方便。他们把CHO细胞免费供给需要的研究机构,使得这一细胞系成为了研究细胞生物学的基本工具之一。后来又衍生出CHO-S、CHO-DXB11、CHO-DG44、CHO-K1SV等等。
工业化生产适用CHO细胞具有以下优势。CHO细胞具有与人类相似的翻译后修饰能力,表达的蛋白生物学活性更加接近天然蛋白,具有生物学活性;仓鼠染色体数较少,CHO细胞具有清晰的历史背景和监管机构的认可,更易于药物生产申报;CHO细胞是一种成纤维细胞,属于非分泌型细胞,它自身很少分泌CHO细胞自身内源蛋白,因此有利于下游工艺的纯化;CHO细胞对外源重组基因有高效扩增和表达能力,并且可过表达目的基因稳定表达在宿主细胞内,易于放大培养,并悬浮达到高密度培养,目前随着表达工艺的优化,蛋白表达量已可超过10g/L的高表达量,有利于大规模生产。
但是尽管如此,CHO细胞表达系统生产生物药还面临着一些挑战。比如重组CHO细胞上游构建与下游分离纯化存在脱节的问题,构建时一般着重考虑目的基因的表达,而忽视了下游工艺纯化的环节;CHO细胞表达的糖基化修饰蛋白不稳定,不易纯化的难题也需要进一步攻克;生产系统自动化程度较低,工艺周期相对较长,生产成本较高等问题。对于CHO细胞未来相关发展,还具有很大的改进空间,无论是从表达体系培养基的完善,还是适用基因编辑技术对CHO细胞自身基因的改善,也希望学术及工艺界早日克服瓶颈,降低人类研发及用药成本。
真核生物系统有着独特的翻译后修饰是原核系统无法替代的,但其工艺及生产成本的相对复杂是人们必须要面对的问题,对于医药明星代表CHO细胞表达系统,相信未来人们也会对此不断进行完善。
参考文献
[1] 张逸驰,李媛媛.昆虫细胞-杆状病毒表达系统的研究进展[J].中国生物制品学杂志,2020,33(12):1454-1459.DOI:10.13200/j.cnki.cjb.003232.
[2] 梁璐琪.昆虫杆状病毒表达系统研究进展及其在疫苗中的应用[J].畜禽业,2014(10):42-43.DOI:10.19567/j.cnki.1008-0414.2014.10.030.

 企业邮箱
企业邮箱 企业OA
企业OA