分子相互作用的检测方法包括酶联免疫吸附分析(ELISA)、免疫印迹(Western Blot)、荧光共振能量转移(FRET)、高效液相色谱法(HPLC)等等,ELISA和WB虽然可用于检测强亲和力的相互作用,但不能分别反应结合和解离作用的强弱,而且检测时间长、通量低、操作步骤较多[1]。现在主流的分子相互作用检测的方法是表面等离子共振技术(Surface Plasmon Resonance,SPR)和生物膜层光学干涉(Bio-Layer Interferometry,BLI)。这两种技术都是非标记技术,并都被美国药典收录(图1),可作为蛋白质、核酸、小分子等物质的亲和力检测、动力学参数检测、结构表征和表位筛选。

图1. SPR和BLI技术收录在美国药典中
原理介绍
两种技术原理不同。SPR技术使用的光源是单波长激光束,经过棱镜产生的多角度光线入射到金属表面时,几乎所有入射的光线都会被反射,但有一个特殊的角度的光线没有被反射出来,而且光子的能量会被金属吸收,进而转化成表面等离子体波,这个特殊的角度称为共振角[2]。由于等离子体波是在金属表面进行传播的,分析物与金属表面偶联的配体蛋白发生相互作用后导致金属膜表面折射率改变,进而导致共振角发生改变[3]。实验中,先将一种配体蛋白固定在金膜表面,然后将与之相互作用的分析物溶液流过芯片表面,随着流路中的分析物与金膜芯片上的配体蛋白发生结合解离作用,膜的厚度发生改变,膜表面折射率发生改变,共振角随之改变。检测器根据检测到的变化绘制曲线,可得到生物分子之间相互作用的信号。

图2. SPR技术原理
BLI是一种利用一次性光纤生物传感器测量生物分子相互作用的光学技术。白光在BLI中沿着生物传感器引导到两个界面:传感器尖端的生物膜表面和内部参考层,光在两层中的每一层都会反射至探测器,而这两束反射光与入射光发生相长干涉或相消干涉,这些干涉光波被光谱仪检测到,并形成一幅干涉光谱,并在传感器上报告为波长的变化(位移Δλ,单位nm),这种位移直接反应出传感器表面生物膜的厚度变化[4]。当生物传感器的尖端浸入样品时,分析物与传感器表面的固定配体发生结合时,传感器尖端的厚度增加,反射光的路径长度比之前更长,使干涉光谱曲线向右产生位移;分析物和固定配体解离时,厚度减少,干涉光谱曲线向左位移[5]。这种位移经检测器监测后,以位移为纵坐标,以时间为横坐标作图,可为分子间相互作用提供准确、全面的动力学数据。
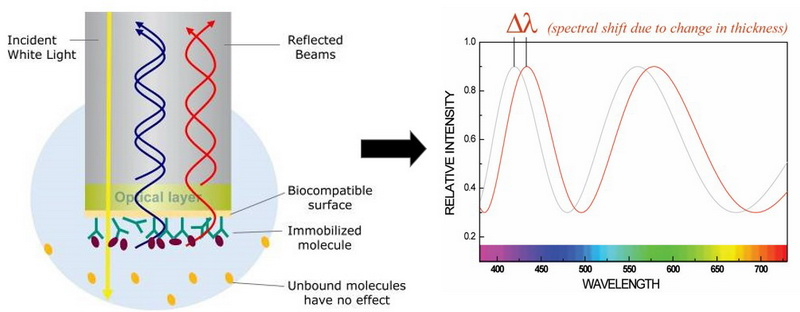
图3. BLI技术原理
用途:
两种技术功能相似,最广泛的用途是用于亲和力检测和动力学分析,不仅能得到亲和力常数,还能得到具体的结合、解离常数。根据待分析物的特性,选择能与分析物发生相互作用的生物传感器(不同的传感器表面固定有不同的分子,如ProteinA、ProteinG、AHC、FAB2G、HIS1K、SA等),在液体系统中实时检测出结合解离信号。常用于抗体Fc端的功能表征,例如和FcRγ蛋白、C1q和FcRn的亲和力检测;配体受体亲和力分析等。
其次,可以用于含量检测,实验时利用不同浓度的标准品得到的不同信号绘制标准曲线,再将样品检测到的信号值带入标准曲线,即可得到浓度值。这两项技术还可以用于表位筛选,不同的抗体可以与相同的抗原结合,但结合表位不一定相同。表位鉴定中,针对同一个抗原的特异性抗体与一组中的所有抗体配对进行测试,以评估它们是否竞争相同表位。
优缺点比较:
SPR将样品作为流体系统,而BLI技术是将传感器浸入至样品中,因此BLI技术样品量少很多。SPR不能检测高折射率样品,如甘油,蔗糖、咪唑、DMSO等,但折射率的变化对BLI信号的影响很小,因此可以分析含有高折射率成分的溶液。BLI技术还可以检测细胞裂解液或培养上清等粗样品,因为只有与生物传感器表面发生结合或解离的分子才会改变生物膜的厚度,周围溶液中未结合的分子不会影响干涉模式。同时,SPR需要大量的仪器维护,实验结束后样品不能回收,这增加了操作时间和成本。
但正因为SPR技术将样品作为流路系统,因此它的分辨力和灵敏度优于BLI。而且BLI技术温控范围有限,样品是放在96孔板或384孔板中进行检测的,这面临着样品蒸发的问题。
总结:
总之,SPR和BLI技术作为分子相互作用分析的强大技术手段,现在应用越来越广泛, SPR技术是实时检测分子相互作用的“金标准”,已经使用了大约二十年[6],而BLI技术虽然使用较晚一些,但由于样品使用量少、通量高、检测快速、仪器使用方便、维护简单等优点成为全球增长最快的非标记技术。
参考文献:
[1]Pall Fortebio,Strategies Using Bio-Layer Interferometry Biosensor Technology for Vaccine Research and Development.Biosensors 2017, 7(4), 49; https://doi.org/10.3390/bios7040049.
[2]Andreea Olaru, Camelia BalaCrit,et al.Surface plasmon resonance (SPR) biosensors in pharmaceutical analysis.Rev Anal Chem. 2015;45(2):97-105. doi: 10.1080/10408347.2014.881250.
[3]Marek Piliarik , et al.Surface plasmon resonance biosensing.Methods Mol Biol. 2009:503:65-88. doi: 10.1007/978-1-60327-567-5_5.
[4]Sriram Kumaraswamy , Renee Tobias.Label-free kinetic analysis of an antibody-antigen interaction using biolayer interferometry.Methods Mol Biol. 2015:1278:165-82. doi: 10.1007/978-1-4939-2425-7_10.
[5]Apiyo, D.O. Biolayer Interferometry (Octet) for Label-free Biomolecular Interaction Sensing. In Handbook of Surface Plasmon Resonance, 2nd ed.; Schasfoort, R.B.M., Ed.; Royal Society of Chemistry: London, UK, 2017;pp. 356–397.
[6]Danlin Yang , Ajit Singh, et al.Determination of High-affinity Antibody-antigen Binding Kinetics Using Four Biosensor Platforms.J Vis Exp (122); 2017.

 企业邮箱
企业邮箱 企业OA
企业OA